导 语
2023 January
18
近期,新冠感染潮在全球多地卷土重来,多国监测数据显示,本轮新冠感染潮与奥密克戎变异株JN.1流行有关。根据最新数据显示,从12月24日到1月6日,JN.1毒株占据了美国新冠病毒检测中的主导地位,占比高达61.6%,成为美国最常检出的新冠毒株。同时,JN.1的感染潮已蔓延至东南亚地区。新加坡博览中心的“方舱医院”重新启动,马来西亚卫生部宣布重启新冠隔离。鉴于新冠病毒变异株JN.1在全球范围内的快速传播,世界卫生组织12月19日发布初步风险评估,将JN.1单独列为“需要留意的变异株”。
中国疾控中心近日发文指出,受JN.1变异株持续输入、国内流感活动逐渐降低和人群免疫水平下降等多因素影响,新冠病毒感染疫情可能在本月出现回升,JN.1变异株大概率将发展成为我国优势流行株。为应对JN.1变异株流行可能导致的新冠感染率上升和医疗系统负担,加快新冠病毒感染治疗药物的研发与供应刻不容缓。
2024年1月18日,具有自主知识产权的国产口服3CL抗新冠病毒药物先诺欣®(先诺特韦片/利托那韦片组合包装)的II/III期临床研究的完整数据首次在线发表于全球权威医学期刊The New England Journal of Medicine(简称NEJM,2022年度影响因子:158.5)。这也是继临床前、I期、Ib期临床研究结果在国际医学期刊发表后,先诺欣®又一获得国际学术界认可的研究成果。
该研究是首个以新冠症状改善为主要研究终点、安慰剂对照且达到阳性终点的国产3CL抗新冠药注册临床研究,也是迄今为止首个大型广泛覆盖感染奥密克戎毒株的中国患者的创新性研究,更符合目前COVID-19疾病特点。
图1. 先诺欣®II/III期临床研究在线发表于 NEJM
疗效与安全性双优,
国产创新药先诺欣®再现原研之光
先诺欣®(先诺特韦片/利托那韦片组合包装)是由先声药业与中科院上海药物研究所、武汉病毒研究所联合研发的国家1类创新药,于2023年1月28日获得国家药监局附条件批准上市,用于治疗轻中度新型冠状病毒感染(COVID-19)的成年患者。先诺欣®上市后,成为我国自主研发、具备自主知识产权的首款以3CL蛋白酶(3CLpro)为靶点的抗新冠病毒口服创新药,为我国COVID-19治疗再添新选择。
2023年12月13日,国家医保局、人力资源社会保障部印发《国家基本医疗保险、工伤保险和生育保险药品目录(2023年)》,先诺欣®正式纳入新版医保目录,每盒/疗程价格降至479元,价格仅为同靶点进口药物的四分之一,药物可及性进一步提高,惠及更多患者。
图2. 先声药业旗下先诺欣®(先诺特韦片/利托那韦片组合包装)
研究设计:
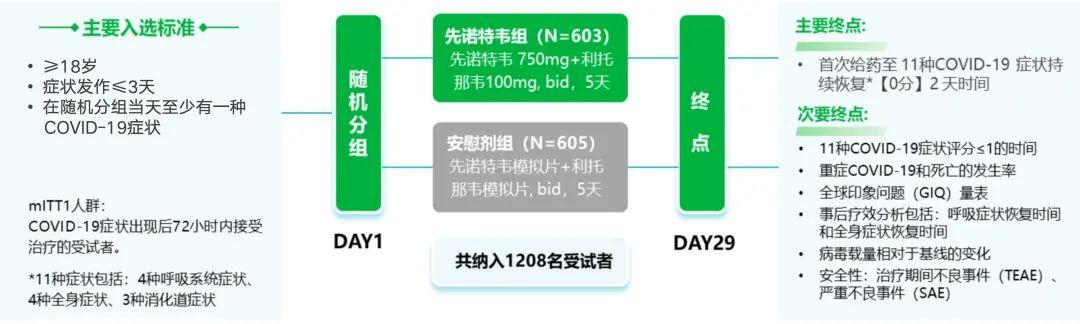
本次刊登在NEJM的II/III期临床研究,是一项多中心、双盲、随机、安慰剂对照研究,旨在探讨先诺欣®治疗轻中度成人新冠患者的有效性和安全性。该研究于2022年8月19日至2022年12月16日,在中国35个研究中心展开,共纳入1208例患者,其中先诺欣®组603例,安慰剂组605例。
主要疗效终点为症状持续恢复的时间,定义为首次给药至11种COVID-19 症状持续恢复【0分】2 天的时间;次要疗效终点为11种COVID-19症状评分≤1分的时间、重症COVID-19和死亡的发生率以及全球印象问题(GIQ)量表;事后疗效分析包括呼吸症状恢复时间和全身症状恢复时间;病毒学终点为病毒载量较基线的变化;安全终点包括治疗期间或随访期间发生的不良事件频率和严重程度。
图3. 研究设计
随着奥密克戎变异株的流行,重症患者数量较前下降,COVID-19感染以轻、中度症状为主要临床特征,但其较强的传播力和免疫逃逸能力使得大量人群存在再次感染的风险。本研究基于奥密克戎变异株感染患者的临床特征进行创新性设计,研究终点的选择更符合目前COVID-19疾病特点,因此能够更加全面、客观地反应先诺欣®的临床应用价值。
研究结果:
研究基线:入组患者中位年龄为35岁,几乎所有患者完成了1次疫苗接种,53.5%的患者有重症高风险因素,大约一半患者在症状出现后48小时内接受了试验方案。入组患者均为奥密克戎毒株感染,包括各种常见奥密克戎变异株,其中以BA.5和BF.7最多,符合2022年下半年中国的流行毒株特征。
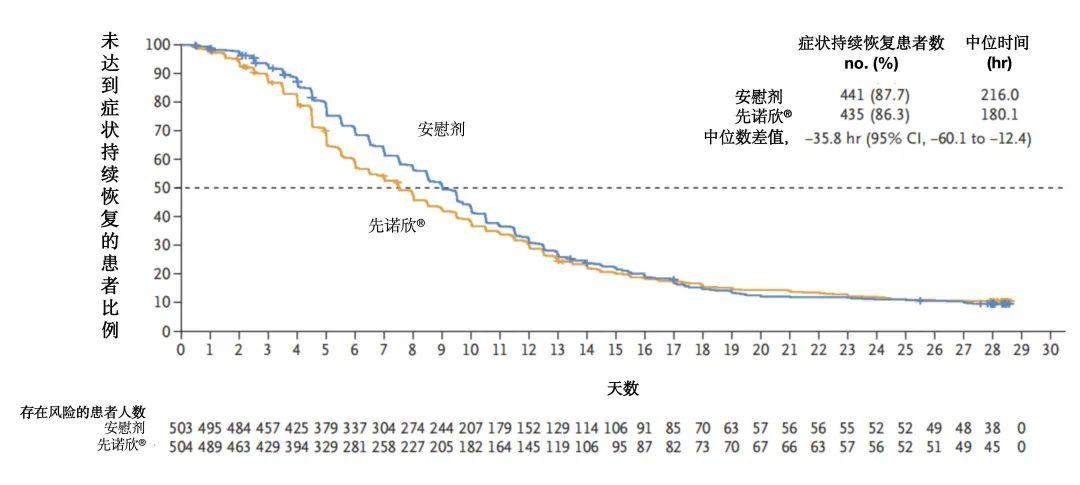
疗效终点:在72小时内接受治疗的改良意向治疗人群(mITT1)中,先诺欣®可显著缩短11种目标COVID-19症状首次达到持续恢复的中位时间(病程)。先诺欣®组和安慰剂组分别为180.1小时和216.0小时(7天 vs 9天),中位差值为35.8小时。
图4. 先诺欣®组与安慰剂组11种新冠症状持续恢复时间
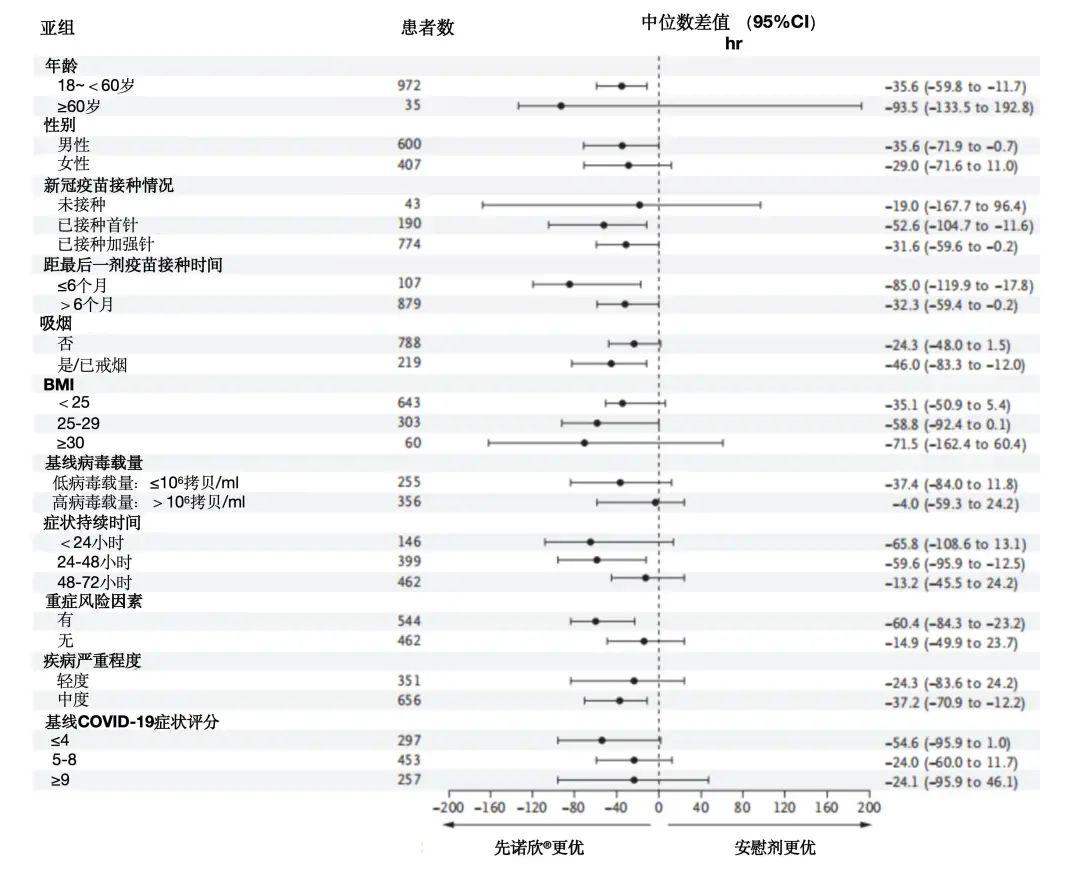
亚组分析:不同年龄、性别、BMI、吸烟状态、疫苗接种情况、症状严重程度、症状出现时间、有无重症高风险因素的患者,使用先诺欣®治疗的效果均优于安慰剂组。并且与安慰剂组相比,在有重症高风险因素、48小时内用药、以及中度症状新冠患者人群中先诺欣®更具疗效优势,其症状持续恢复时间的中位差值分别为-60.4小时,-59.6小时和-37.2小时。
图5. 新冠症状持续恢复时间的亚组分析
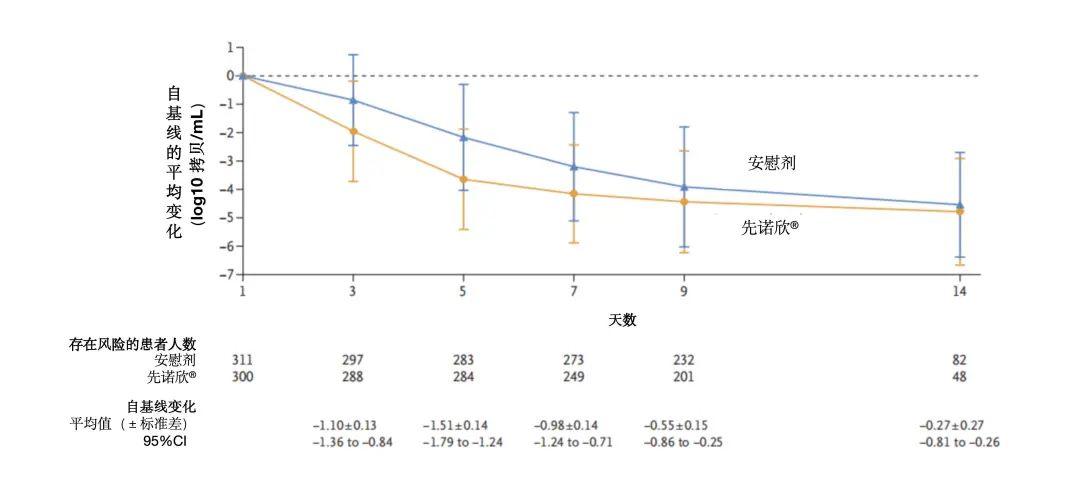
病毒学终点:先诺欣®组接受治疗后病毒载量呈现快速、大幅下降。在72小时内接受治疗的改良意向治疗人群(mITT1)中,用药后第5天,与安慰剂组相比,先诺欣®组病毒载量下降幅度达96.9%(-1.51 log10拷贝/mL),在第9天,仍然可以观察到先诺欣®组病毒载量与安慰剂组的差异;且症状出现48小时内用药亚组病毒载量下降更大,差值为-1.74 log10拷贝/毫升。提示越早用药治疗,病毒载量下降越多。
图6. mITT1人群中先诺欣®组与安慰剂组病毒载量变化
安全性终点:先诺欣®组(29.0%)整体不良事件发生率略高于安慰剂组(21.6%)。先诺欣®组的不良事件均为轻度或中度,且无需药物干预可自行好转,未发现严重不良事件,提示先诺欣®整体安全可耐受。
研究结论:
先诺欣® II/III期临床研究首次验证了其在大规模新冠感染中国患者中应用的安全性和有效性。研究结果证实了先诺欣®对于新冠病毒的高效抑制作用,可显著缩短患者11种症状持续恢复时间,显著降低病毒载量,且安全性良好,期间未发生严重不良事件。
先诺欣®进一步完善强大循证医学
证据链,助力新冠感染常态化防控
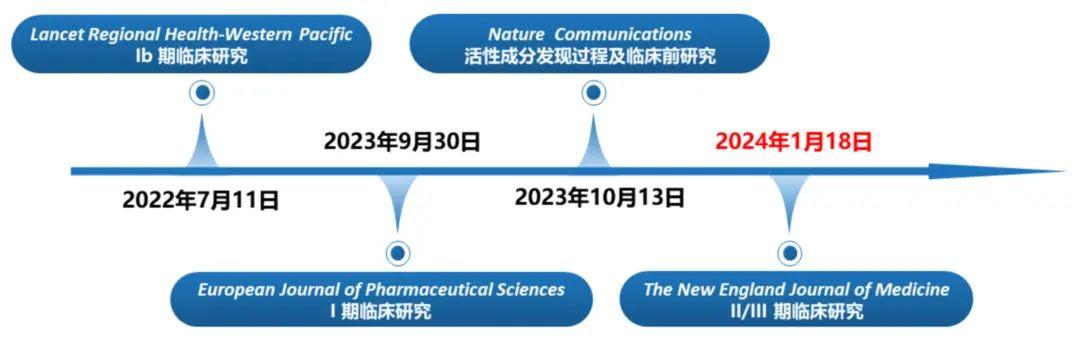
此前,先诺欣®活性成分先诺特韦的发现过程及其临床前研究、I期临床研究、Ib期临床研究结果,分别发表于三大国际知名医学期刊 Nature Communications、European Journal of Pharmaceutical Sciences、Lancet Regional Health-Western Pacific,药物安全性和有效性得到国际学术界多次认可。
据公开发表的研究数据显示,先诺特韦可有效抑制冠状病毒3CLpro,具有高选择性,联合利托那韦可有效抑制肺部和脑部病毒复制,在健康成人患者和COVID-19患者中均表现出良好的安全性、耐受性以及良好的药代动力学特征。先诺欣®对轻中度新型冠状病毒感染成年患者有显著的临床疗效,具有快速和大幅度降低病毒载量、缩短病程和核酸转阴时间、3CL靶点更为安全可靠等三大特点。研究同时表明,重症高风险人群用药后获益明显,症状恢复时间显著缩短。
图7. 先诺欣®循证医学证据链
此次先诺欣® II/III期临床研究于NEJM的成功发表,进一步在大样本人群中验证其治疗新冠病毒感染的有效性和安全性,同时也体现国际学术界对中国新冠药物研发的高度关注。基于新冠病毒感染的疾病特征变化和未被满足临床需求,先诺欣®在NEJM上的首次亮相进一步完善其强大循证医学证据链,充分展现了我国医药自主研发和创新实力。
图8. 美国疾病控制与预防中心(CDC)关于JN.1变异株的声明
JN.1变异株是新冠病毒奥密克戎BA.2.86 变异株的第二代亚分支,也是BA.2.86变异株中具有较强传播优势的一个亚分支。美国CDC指出,JN.1和BA.2.86在刺突蛋白上仅有一个氨基酸位点突变,现有针对新冠病毒的疫苗、病原学检测方法和治疗方法仍对JN.1变异株感染有效。
先诺欣®作为先声药业旗下首款国产3CL抗新冠创新药,自2023年初上市以来已成为我国居民抗新冠治疗的有力手段。截至12月,先诺欣®已覆盖全国32个省、306个市及超2500家医疗机构,累计帮助近70万患者。面对JN.1变异株流行导致的新冠感染上升态势,先诺欣®循证医学证据优势明显,同时已纳入新版医保目录,可及性进一步提高,能够更有效地助力我国新冠感染常态化防控。
二维码
关注CCMTV

CCMTV APP下载

关注CCMTV云管家