摘要
2023年欧洲肿瘤内科学会亚洲年会(ESMO Asia)已于12月1日至3日在新加坡举行。本次大会上报道了2期DeLLphi-301研究结果(508MO),双特异性T细胞衔接蛋白(BiTE)Tarlatamab在既往经治的小细胞肺癌(SCLC)患者中的疗效和安全性。日前,基于DeLLphi-301研究结果,美国FDA已接受Tarlatamab的生物制品许可申请(BLA),旨在治疗铂类化疗期间或之后疾病进展的晚期SCLC成年患者。如果获得批准,Tarlatamab将成为首个用于治疗实体肿瘤的BiTE疗法。该申请已被授予优先审评资格,PDUFA目标日期为2024年6月12日。Tarlatamab的疗效和安全性究竟如何?CCMTV小编特此编译,以飨读者。
关注公众号,回复关键词asia2023,获取PDF摘要集! 背景
SCLC侵袭性强,患者生存预后较差。Tarlatamab是一种BiTE,通过同时结合肿瘤细胞上的δ样配体3(DLL3)和T细胞上的CD3,将T细胞募集到SCLC细胞附近,激活T细胞杀伤肿瘤细胞,促进肿瘤的消退。本次报道2期DeLLphi-301研究Tarlatamab用于既往≥2线经治的晚期SCLC的结果。
图. Tarlatamab作用机制
方法
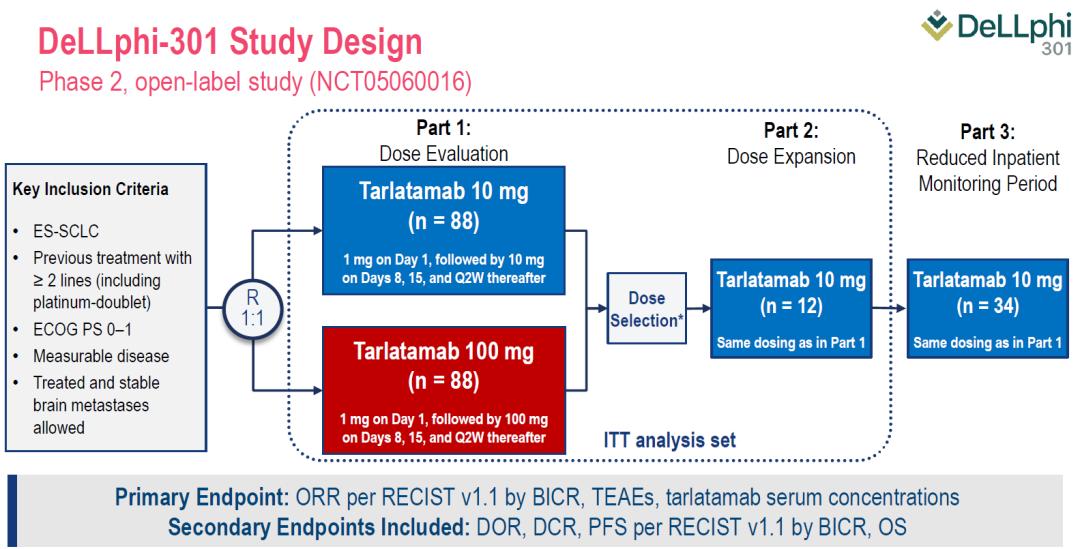
研究纳入既往≥2线经治(包括含铂双药化疗)的ES-SCLC患者,接受Tarlatamab 10mg或100mg Q2W治疗,研究分为剂量评估、剂量扩展和缩短住院监测3个部分。主要终点为盲态独立中央审查(BICR)评估的客观缓解率(ORR)、治疗期间出现的不良事件(TEAE)和Tarlatamab血清浓度。次要终点包括缓解持续时间(DOR)、疾病控制率(DCR)、无进展生存期(PFS)和总生存期(OS)。本次报道Part1、2患者(ITT人群)的疗效,以及Part1、2、3患者的安全性。
图. DeLLphi-301研究设计
结果
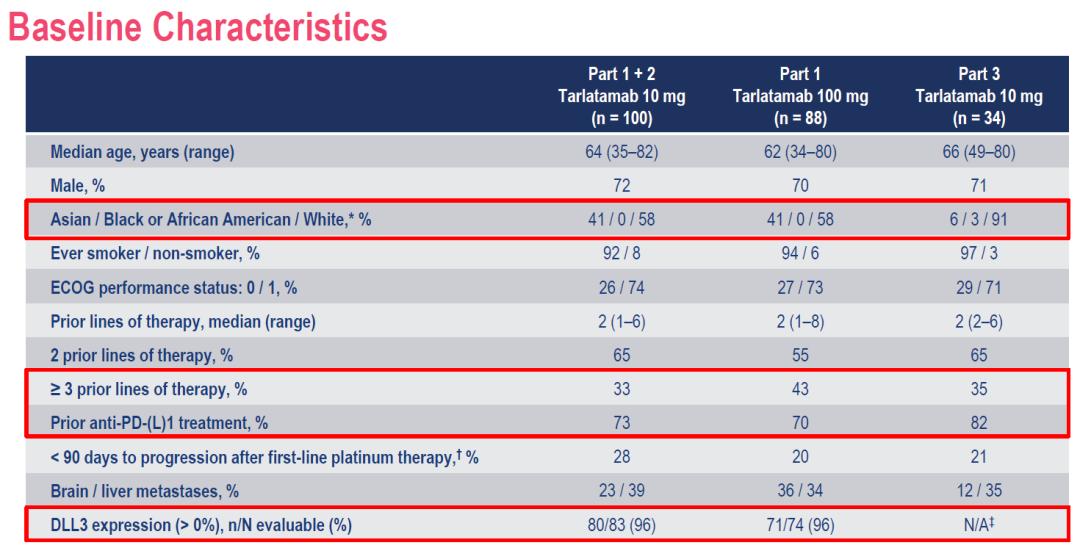
Part1+2中接受Tarlatamab 10mg治疗、Part1中接受Tarlatamab 100mg治疗和Part3中接受Tarlatamab 10mg治疗的患者分别为100例、88例和34例。其中,亚裔患者分别占41%、41%和6%;中位既往治疗线数均为2线,既往≥3线经治患者分别占33%、43%和35%;分别有73%、70%和82%的患者既往接受过免疫治疗;DLL3表达情况如下。 图. DeLLphi-301研究患者基线特征 疗效
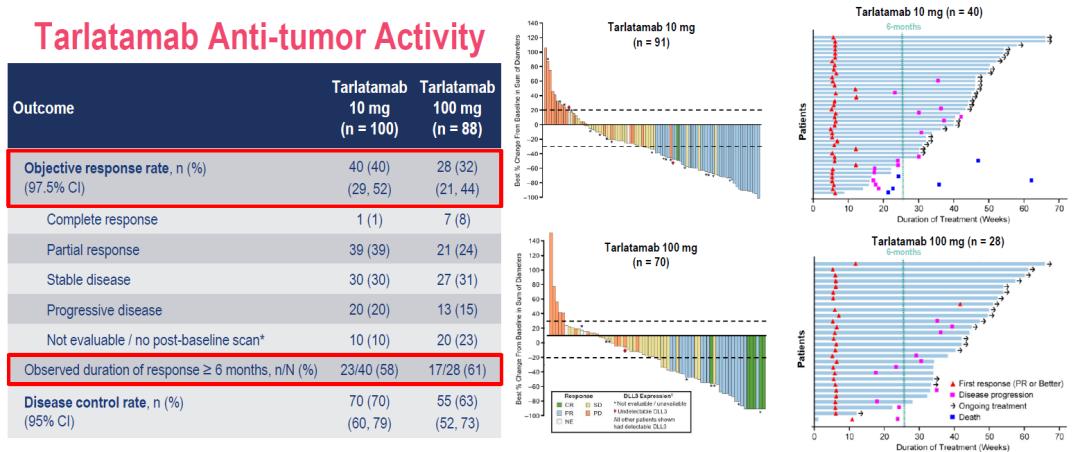
ITT人群中,Tarlatamab 10mg剂量下的ORR为40%,DCR为70%,58%的患者DOR≥6个月;
100mg剂量下的ORR为32%,DCR为63%,61%的患者DOR≥6个月。
无论患者DLL3表达与否,包括没有可评估肿瘤组织的患者,都观察到疗效。
Tarlatamab起效迅速且疗效持久,中位起效时间仅为1.4个月,中位DOR尚未达到。 图. DeLLphi-301研究ITT人群疗效
所有预设亚组均观察到客观缓解,包括亚裔患者。亚裔患者中,Tarlatamab 10mg剂量下的ORR为46.3%,100mg剂量下的ORR为25.0%。
图. DeLLphi-301研究ITT人群疗效亚组分析
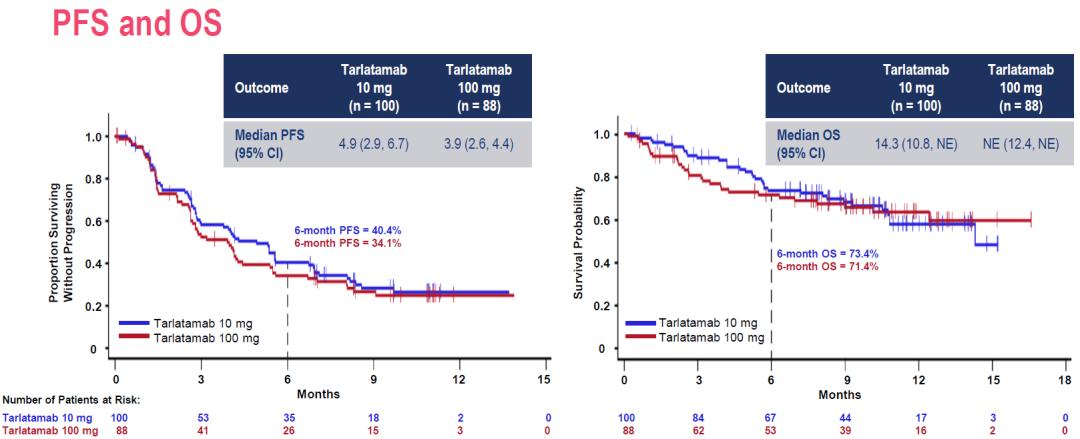
Tarlatamab 10mg剂量下的中位PFS更长,为4.9个月,而100mg剂量下的中位PFS为3.9个月,6个月PFS率分别为40.4%和34.1%。 OS数据目前尚未成熟,Tarlatamab 10mg剂量下57%的患者和100mg剂量下51%的患者仍然存活,6个月OS率分别为73.4%和71.4%。 图. DeLLphi-301研究ITT人群PFS和OS
安全性
Tarlatamab 10mg的安全性优于100mg。Part1+2(10mg)、Part1(100mg)和Part3(10mg)的≥3级TRAE发生率分别为29%、33%和15%,因TRAE导致的治疗中断发生率为14%、29%和9%,因TRAE导致的停药率较低,为4%、3%和0。缩短住院监测时间(Part3)不改变安全谱。 最常见的(≥20%)TEAE为细胞因子释放综合征(CRS),主要发生在第一或第二剂,绝大多数为1~2级,≥3级CRS发生率为0、6%和3%,大多数CRS可通过支持治疗得到控制。 图. DeLLphi-301研究安全性
结论
Tarlatamab 10mg表现出持久的抗肿瘤活性和可控的安全性,ORR为40%,≥6个月DOR率为58%,6个月PFS率为40%,6个月OS率为73%;最常见的TEAE为CRS,主要发生在第一或第二剂,绝大多数为1~2级,大多数CRS可通过支持治疗得到控制;因TRAE导致的停药率较低。因此,Tarlatamab 10mg是进一步研发的选定剂量。 研究结果支持在经治SCLC患者中应用Tarlatamab治疗,目前研究结果已全文发表于《新英格兰医学杂志》(NEJM)。基于DeLLphi-301研究结果,美国FDA已接受Tarlatamab的生物制品许可申请(BLA),旨在治疗铂类化疗期间或之后疾病进展的晚期SCLC成年患者。如果获得批准,Tarlatamab将成为首个用于治疗实体肿瘤的BiTE疗法。目前,3期DeLLphi-304研究正在进行中,该研究将对比Tarlatamab(10mg Q2W)与标准化疗的疗效和安全性,让我们共同期待Tarlatamab的获批与更多研究数据的披露。
关注公众号,回复关键词asia2023,获取PDF摘要集!
参考文献
REFERENCES
L. Paz-Ares, M. Ahn, E. Felip, et al. Tarlatamab for patients (pts) with previously treated small cell lung cancer (SCLC): Primary analysis of the phase II DeLLphi-301 study. 2023 ESMO ASIA. Abs 508MO.
编辑|梅婕
审核|叶静 责编|赵德云
— END — CCMTV肿瘤频道视频号已上线!
带您洞察肿瘤前沿资讯 精彩不断,敬请关注!
点击下方“阅读原文” 访问更多CCMTV肿瘤科频道精彩内容
二维码
关注CCMTV

CCMTV APP下载

关注CCMTV云管家