泽沃基奥仑赛注射液(zevorcabtagene autoleucel,简称zevor-cel,研发代号:CT053)是一种用于治疗复发/难治多发性骨髓瘤的全人源自体抗BCMA CAR-T细胞候选产品 ,由科济药业和华东医药在中国大陆地区进行商业化合作。全人源的25C2 单链抗体具有更高的亲和力和稳定性,升级的结构设计增强了临床疗效和安全性。LUMMICAR STUDY 1是一项在中国开展的Ⅰ/Ⅱ期临床研究,旨在评估泽沃基奥仑赛注射液治疗复发/难治多发性骨髓瘤(R/R MM)的安全性和有效性。2021年ASH会议公布了LUMMICAR STUDY 1研究中Ⅰ期随访 1年的结果:总缓解率(ORR)为100%,严格意义的完全缓解/完全缓解 (sCR/CR) 率为 78.6%1。
2023年ASH会议上更新了LUMMICAR STUDY 1研究中Ⅰ期最后一例患者回输后3 年的长期随访结果。
研究方法 该研究纳入了符合IMWG诊断标准的多发性骨髓瘤患者。受试者需同时满足:①年龄在18至75岁之间;②诊断为复发/难治多发性骨髓瘤;③ECOG评分为0分或1分的患者;④既往至少接受过3种治疗方案,包括至少一种蛋白酶体抑制剂和一种免疫调节药物。 泽沃基奥仑赛注射液(zevor-cel)剂量递增阶段观察 2 个剂量组,单次输注的细胞剂量分别为,剂量 1(1.0×108),剂量 2(1.5×108);综合获益风险评估,支持 1.5×108 细胞单次输注是适宜的Ⅱ期临床试验剂量,Ⅰ期研究的主要目的为探究泽沃基奥仑赛注射液的安全性、耐受性和摸索Ⅱ期推荐剂量。疗效评估由研究者根据 IMWG 2016 标准进行。微小残留病(MRD)检测为10-5水平的 EuroFlow 检测法检测。 结果更新 自2019年7月23日,研究纳入14例患者,中位年龄54岁(34,62),所有患者中,50.0%的患者具有细胞遗传学高危因素,14.3%的患者伴髓外病变,14.3%的患者伴国际分期系统(ISS)的III期疾病,21.4%的患者骨髓浆细胞占50%及以上,78.6%的患者接受了自体干细胞移植,100%的患者双重耐药。
截至2023年7月17日,中位随访37.7个月 (14.8,44.2)。ORR为100%。sCR/CR率为78.6%,92.9%的患者达到了非常好的部分缓解(VGPR)及以上。中位至首次缓解的时间为28天,中位到达最佳缓解的时间为57天。所有达到sCR或CR的患者,均为MRD阴性(10-5水平)。
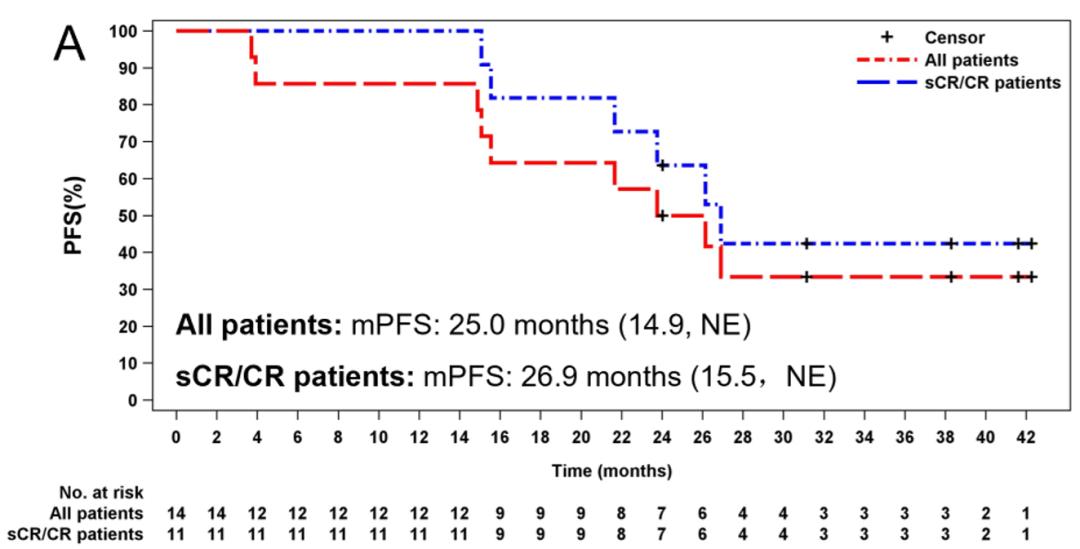
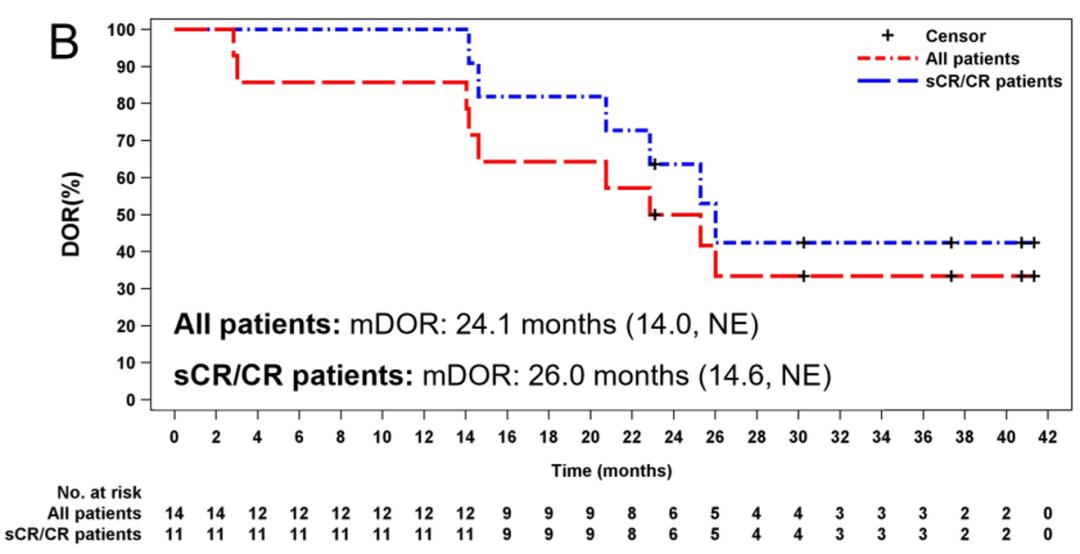
所有患者的中位PFS为25.0个月 (14.9 ,不可评估 [NE]),sCR/CR 患者的中位PFS为26.9个月 (15.5,NE)。所有患者的中位缓解持续时间为 24.1 个月 (14.0,NE ),sCR/CR患者的中位缓解持续时间为 26.0 个月 (14.6,NE)。
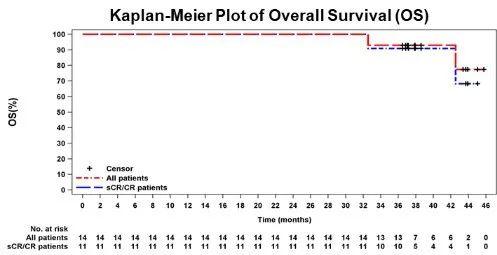
图1 泽沃基奥仑赛输注后所有患者以及sCR/CR患者的PFS和DOR 在数据截止日期时,中位总生存期(OS)尚未达到。在24个月时,OS率100%,在36个月时,OS率仍然处于92.9%。截止2023年7月17日,有4例sCR患者仍持续响应,7例患者响应持续超过24个月。这些结果表明,在CAR-T回输后3年,相当大比例的患者仍然生存。这进一步证实了该治疗方案在改善骨髓瘤患者生存方面的潜力。
图2 泽沃基奥仑赛输注后所有患者以及sCR/CR患者的OS 在更长的随访时间内,未出现新的安全性信号。在数据截止时,研究中未发生与治疗相关的死亡,13例患者(92.9%)出现细胞因子释放综合征(CRS),均为1级或2级,无3级以上CRS发生。未出现免疫效应细胞相关神经毒性综合征(ICANS)、第二原发性恶性肿瘤和自身免疫性疾病的报告、未出现帕金森综合征。到目前为止,所有患者的慢病毒复制能力检测结果均为阴性。
结论 更长的随访时间内,泽沃基奥仑赛注射液对于既往多重治疗的MM患者显示了快速、深度和持续的缓解,无新的安全性信号出现。该治疗方案安全性评估结果表明其具有可控且良好的安全性。
专家点评 泽沃基奥仑赛注射液(CT053)是一种用于治疗复发/难治性多发性骨髓瘤的全人源抗 BCMA CAR-T细胞疗法。该药物于2019年获得FDA再生医学先进疗法(RMAT)及孤儿药称号,于2019年及2020年获得EMA的优先药物(PRIME)及孤儿药产品称号,于2020年获得国家药监局突破性治疗资格认定。
本次ASH会议更新了LUMMICAR STUDY 1研究Ⅰ期最后一例受试者回输后3 年的数据,泽沃基奥仑赛注射液在这些患者中显示了深度且持久的缓解,ORR为100%,sCR为78.6%,所有sCR的患者均达到10-5 MRD阴性。所有患者中,中位无进展生存期为25.0个月。数据截止时,中位OS未达到,36个月OS率为92.9%,这是目前抗BCMA CAR-T细胞治疗临床研究中最高的3年生存率。在安全性上,泽沃基奥仑赛注射液耐受性良好,安全性可控,未发生3级以上CRS和ICANS,未发生与治疗相关的死亡,未出现抗药抗体(ADA)阳性的患者,且3级以上血液学毒性、感染等与同类BCMA CAR-T产品相比,发生率低。这些数据进一步显示了泽沃基奥仑赛注射液在接受过多重治疗的RRMM患者中良好的安全性和疗效。
目前正在进行的 LUMMICAR STUDY 1(NCT03975907)Ⅱ期研究,纳入了既往接受过至少三线治疗的102 名复发/难治多发性骨髓瘤受试者,对泽沃基奥仑赛注射液的安全性、有效性和药代动力学进行为期24个月的评估。目前观察到缓解深度随随访时间的延长呈上升趋势;≥VGPR的患者为85.3% ,其中获得CR/sCR的患者100%达到10-5水平MRD阴性2。
泽沃基奥仑赛注射液的新药申请在2022年10月已获中国国家药品监督管理局受理,并获得优先审评。我们期待泽沃基奥仑赛注射液后续带来更多优异的成绩,早日上市惠及更多患者!
傅琤琤 教授
苏州大学附属第一医院
血液科副主任,主任医师 副教授,博士生导师 中华医学会血液分会浆细胞学组副组长 中国医师协会血液分会骨髓瘤专家委员会委员 中国抗癌协会血液肿瘤分会委员 女医师协会靶向治疗专委会委员 女医师协会多发性骨髓瘤及相关疾病专业学组副组长 江苏省抗癌学会血液肿瘤分会,江苏省医学会血液分会,江苏省研究型医院协会浆细胞疾病学组组副组长 中国医药教育协会血液学专业委员会主任常务委员 亚太骨髓瘤网成员 国际骨髓瘤协会成员 作为项目负责人先后获江苏省卫生厅科教兴卫重点人才基金,国家自然科学基金、江苏省自然科学基金,中国抗癌协会血液肿瘤专业委员会基金。获得过教育部、科技部科技进步二等奖,江苏省新技术引进奖等。 参考文献:
1.Blood (2021) 138 (Supplement 1): 2821
2.Blood (2022) 140 (Supplement 1): 4564–4565.
荟萃名家 聚焦临床
欢迎关注CCMTV·血液频道!
CCMTV血液频道视频号已上线! 带您了解最新血液资讯 精彩不断,敬请关注!
二维码
关注CCMTV

CCMTV APP下载

关注CCMTV云管家