摘要
HER3是一种ERBB受体,在许多肿瘤类型中与预后不良有关,从发现至今三十多年以来,尚未有针对HER3的药物获批上市。Patritumab deruxtecan(HER3-DXd,U3-1402)是靶向HER3的新一代ADC,具有连接子可裂解、载荷活性强、抗肿瘤“旁观者效应”等药物优势。近日,HER3-DXd的SOLTI TOT-HER3(NCT04610528)机会窗试验,即介于诊断和标准治疗过程当中的窗口期研究,探讨了生物标志物和相关的新型靶向药物治疗疗效的相关性,其Part A最终结果发表在Annals of Oncology杂志上。 研究设计
SOLTI TOT-HER3研究是一项机会窗、多中心、单臂、术前试验,旨在评估单剂量HER3-DXd治疗初治早期乳腺癌患者的疗效。入组患者为未经治疗、原发肿瘤≥1cm、Ki-67≥10%、可手术的HER2-乳腺癌,其中 A部分患者为HR+/HER2-,接受1剂6.4 mg/kg HER3-DXd治疗; B部分患者包括HR+/HER2-和三阴性乳腺癌(TNBC)两个队列,接受1剂5.6 mg/kg HER3-DX治疗。 A部分的主要目的在于评估HER3-DXd治疗前后(基线和第1周期第21天,C1D21)的肿瘤细胞及肿瘤浸润性淋巴细胞(CelTIL)评分变化。次要目的包括C1D21评估的客观缓解率(ORR)、根据ERBB3 mRNA和HER3蛋白质和基于HER3-IHC蛋白基线表达水平的CelTIL评分的变化、基于HER3-IHC的表达与ERBB3 mRNA表达的相关性、基于PAM50特征的CelTIL评分的变化、安全性和耐受性等。
图. SOLTI TOT-HER3研究设计
研究结果
A部分纳入78例患者,在ERBB3 mRNA分组中,超低组有15例患者,低、中、高mRNA组各有21例。67例(86%)患者的HER3 IHC蛋白表达可评估,其中,12例(17.9%)为HER3低表达(25%~74%),1例(1.5%)为HER3阴性(<25%)。
图. ERBB3 mRNAa和基线HER3膜蛋白表达在所有筛查患者和入组患者中的分布
所有患者和基于临床应答的CelTIL评分
CelTIL评分在1例患者的C1D21活检中无法评估,因此对总共77例患者进行主要疗效分析。
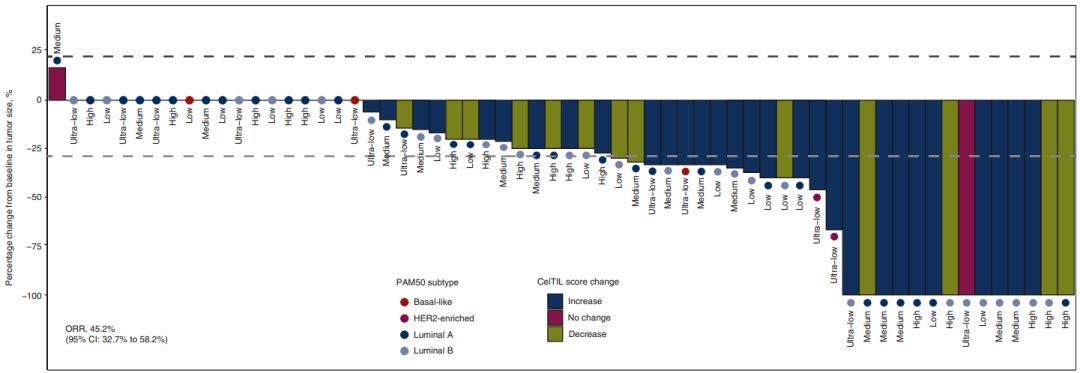
中位CelTIL评分升高3.5(IQR 3.8-12.7;Wilcoxon signed-rank test P=0.003),平均升高6.9(95%CI 3.40-10.19)。77例患者中,62例临床疗效可评估,ORR为45.2%,其中14例完全缓解(CR),14例部分缓解(PR,各22.6%)。CelTIL评分在肿瘤应答人群中有更显著的升高(中位升高+11.9),相较于疾病稳定(SD)的人群(中位升高+1.9)。
图. C1D21与基线的肿瘤大小变化,并基于PAM50固有亚型、ERBB3 mRNA队列和CelTIL评分变化
图. 所有患者(A)和基于临床应答(B)的CelTIL评分变化
基于基线ERBB3 mRNA水平、HER3蛋白表达和PAM50亚型的CelTIL评分变化和临床应答
CelTIL评分变化或临床应答与基线ERBB3 mRNA和HER3水平无关。
基线样本中基于PAM50的亚型分布如下:luminal A型51.9%(n=40);luminal B型41.6%(n=32);基底细胞亚型3.9%(n=3);HER2富集型2.6%(n=2)。
接受治疗后,29例患者(37.7%)发生PAM50亚型转变:21例luminal B型转变为luminal A型(n=20)和HER2富集型(n=1);6例luminal A型转变为luminal B型(n=2)和普通型(n=4);1例HER2富集型转变为luminal A型;1例基底细胞亚型转变为luminal B型。3例患者在治疗后活检中没有发现残留肿瘤,他们在基线时分别为luminal A型、luminal B型和HER2富集型。
与luminal型和低/中PAM50复发风险(ROR)相比,基线非luminal型和高ROR在C1D21时的CelTIL评分升高更多。
图. 自基线至C1D21的PAM50和ROR转变
自基线至C1D21不同基因表达和生物标志物变化
对74个配对肿瘤样本的分析显示,与基线活检相比,23个基因在C1D21时上调(包括免疫相关基因如CD8A、CD4和PDCD1),44个基因下调(包括增殖相关基因如MELK、MKI67和UBE2T)。
安全性
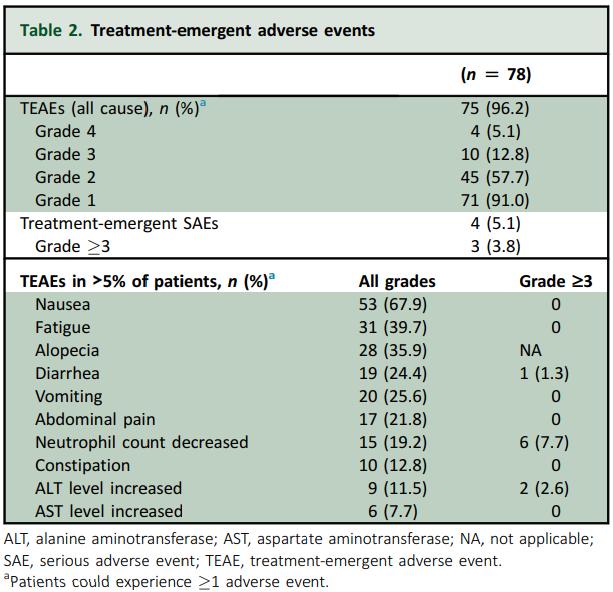
≥3级治疗期间不良事件(TEAE)发生率为17.9%,均可逆。未报道间质性肺疾病和死亡事件。
表. TEAE
研究结论
对于未接受过任何治疗的HR+/HER2-早期乳腺癌患者,6.4 mg/kg剂量下HER3-DXd单药治疗1剂的ORR为45.2%。 基线ERBB3 mRNA或HER3 IHC表达与CelTIL评分变化无关。但是,观察到的肿瘤微环境变化和有潜力的ORR,可能会转化为新辅助治疗中应答率的提高和长期结果的改善。 低HER2 IHC与HER3-DXd疗效密切相关,提示HER3-DXd可能对极低HER2表达的HR+乳腺癌患者具有更高活性,可为这部分患者提供新的治疗选择。 接受1剂HER3-DXd治疗后达到CR或PR的患者,较达到SD的患者有更明显的免疫浸润。提示,后续抗PD-1/PD-L1相关的免疫治疗可能会和HER3-DXd的药物存在协同治疗的作用,与既往临床前研究的结果一致,也为后续临床实践中的应用提供了很好的启示。 安全性可耐受,与既往报道一致。 VALENTINE研究(NCT05569811)已启动,以进一步验证这些发现。
参考文献
REFERENCES
Oliveira M, Falato C, Cejalvo JM, et al. Patritumab deruxtecan in untreated hormone receptor-positive/HER2-negative early breast cancer: final results from part A of the window-of-opportunity SOLTI TOT-HER3 pre-operative study. Ann Oncol. 2023 Aug;34(8):670-680.
编辑|梅婕
审核|叶静 责编|赵德云 — END — 汇集最新最全的肿瘤资讯
欢迎关注CCMTV临床频道·肿瘤之音!
点击下方“阅读原文” 访问更多CCMTV肿瘤科频道精彩内容
二维码
关注CCMTV

CCMTV APP下载

关注CCMTV云管家