点击标题下「蓝色微信名」可快速关注
引用本文:李博, 胡刚, 邱文龙, 等. 腹腔镜下盆腔腹膜后肿瘤经肛门取标本手术(附视频)[J/OL]. 中华结直肠疾病电子杂志, 2023, 12(1): 85-88.
摘要 随着微创理念的深入人心,经自然腔道取标本手术(NOSES)凭借最小的手术代价换取最优的手术效果这一独特优势,迅速引领世界微创和加速康复外科研究。NOSES从最初治疗结直肠肿瘤,扩大到腹盆腔各类良恶性疾病;从单一脏器切除扩大到联合脏器切除,越来越多的实践案例和研究验证了NOSES在临床应用的安全性和有效性。目前,尚无NOSES应用于盆腔腹膜后肿瘤的文献报道。本例报告一例青年女性盆腔腹膜后肿瘤患者成功完成腹腔镜下盆腔腹膜后肿瘤经肛门取标本手术并附手术视频。
经自然腔道取标本手术(natural orifice specimen extraction surgery,NOSES)是指使用腹腔镜、机器人手术系统等内窥镜设备监视下完成腹盆腔内肿瘤或器官的切除与重建,经人体直肠、阴道或口腔取标本的手术 [1] 。随着微创理念的深入人心,NOSES凭借最小的手术代价换取最优的手术效果这一独特优势,迅速成为国内外微创和加速康复外科的研究热点。在国内,截至2020年12月,我国共有 373 家医疗机构开展 NOSES,共计完 成NOSES手术20 799例 [2] 。在国际上,随着越来越多的研究印证了NOSES的安全性和有效性,国外专家与学者逐渐摒弃质疑转而接受 NOSES,使NOSES得以在越来越多的国家与地区开展 [3] 。在手术范围上,NOSES从最初治疗结直肠肿瘤,扩大到腹盆腔各类良恶性疾病;从单一脏器切除扩大到联合脏器切除[1, 4] 。基于 NOSES 的应用价值,我们在盆腔腹膜后肿瘤做出了新的尝试。盆腔腹膜后肿瘤(pelvic retroperitoneal tumor,PRT)发生于盆腔腹膜后间隙,该间隙空间狭小并且解剖复杂,肿瘤发现时平均直径近10 cm,是腹盆腔手术难点之一[5-7] 。目前,国内外尚无采用NOSES治疗PRT相关的文献报道。
中国医学科学院肿瘤医院结直肠外科近期成功实施1例腹腔镜盆腔腹膜后肿瘤切除并经肛门取标本术,手术过程顺利,术后治疗效果满意,现报告如下。
一、患者资料
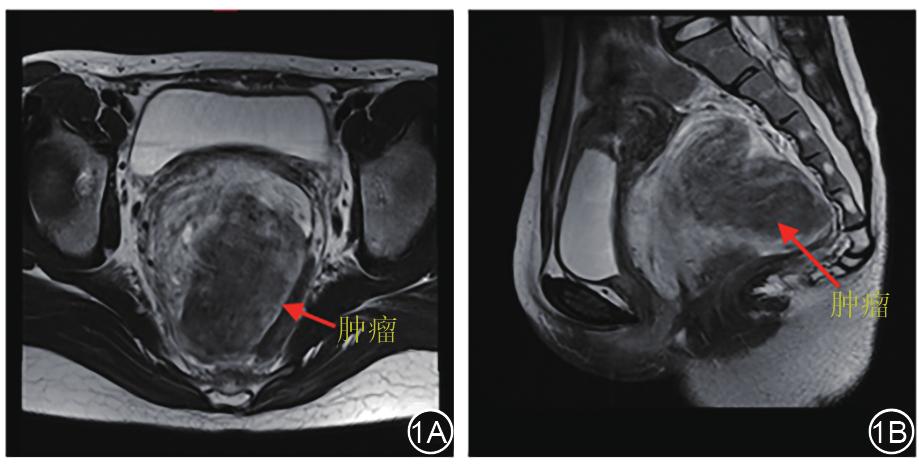
患者女性,19岁,BMI:19.0 kg/m 2 。因“排便困难1年”入院。查体:距肛缘2 cm,齿状线水平,膝胸位0~6点处巨大直肠壁外外压性肿物,质韧,活动度差,黏膜未见溃疡及占位。盆腔MRI:盆底阴道后方直肠左旁巨大肿物,边界尚清,信号不均匀,大小约9.2 cm×8.4 cm×9.9 cm,增强可见渐进性明显强化,推压子宫、宫颈、阴道及直肠,局部与直肠下段分界欠清(图 1A、图 1B)。影像学诊断:盆底阴道后方直肠左旁巨大肿物,倾向间叶组织来源,侵袭性血管黏液瘤(aggressive angiomyxoma, AA)可能,拟行腹腔镜盆腔肿瘤切除术。
图1 术前MRI显示肿瘤位于盆腔,与直肠关系密切。1A:轴位,1B:矢状位
二、手术方法及过程
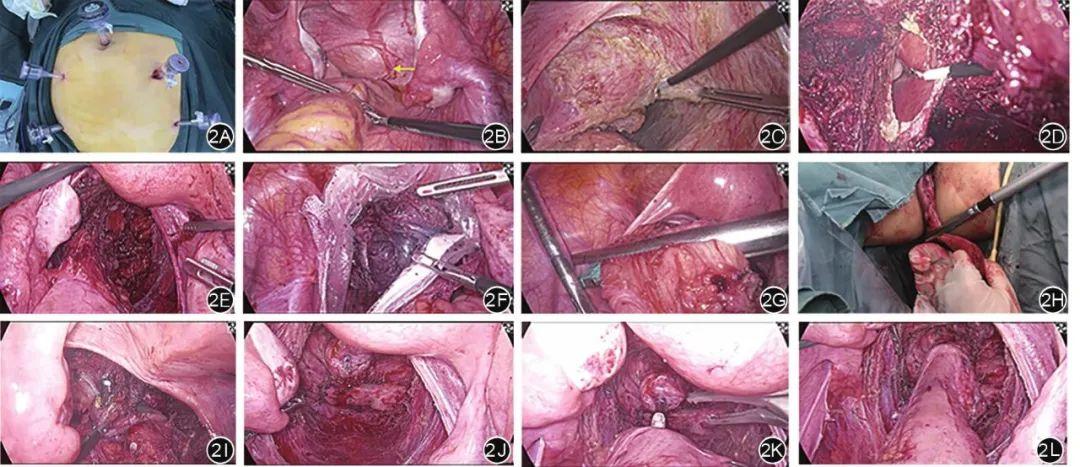
腹腔镜探查及肿瘤切除:全身麻醉后,脐上2 cm作长约1 cm皮肤切口,建立腹腔镜观察孔,建立气腹,腹壁五孔法布孔(图2A)。探查腹腔:盆腔未见腹膜转移灶,肝胆胰脾未见异常。肿瘤位于盆底,将直肠挤压向右侧,肿瘤与下段直肠肠壁及阴道粘连紧密(图2B)。于骶骨岬下方直肠系膜与腹膜交界中线切开,向下游离直肠后间隙,分离至肛提肌间隙。沿肿瘤后壁、前壁、右侧壁、左侧壁游离肿瘤(图2C),右侧壁侵及直肠,游离距肛提肌上方2 cm处切开直肠肠腔,切除受累肠壁大小约3.0 cm(图2D)。将瘤体连同部分肠壁自盆腔完全游离(图2E)。
标本取出:术中探查肿瘤质地柔软,决定试行经肛门取出标本。使用碘伏水冲洗消毒末端直肠,扩肛至能容4指。经腹部Trocar将无菌塑料套管置入腹腔,助手使用卵圆钳经肛门将无菌塑料套管拖出肛门。在主刀协助下,助手使用卵圆钳将肿瘤拖入直肠,并将无菌塑料套管白边带收紧,助手将标本连通无菌塑料套管经直肠肛门拖出体外,完成标本的取出(图2F)。
消化道重建:再次消毒肠管,经肛门将抵钉座置入近端肠管,助手展平乙状结肠系膜,裁剪乙状结肠系膜,于直肠上段裸化肠管壁,直线切割缝合器完成肠管离断(图2G)。肛门冲洗后,经肛门放置有齿卵圆钳,将远端肠管拖出肛门外,1 500 mL碘伏水冲洗肠管,适形离断直肠(图2H)。探查乙状结肠系膜无扭转,使用电钩于近端肠管短端一角打开肠壁露出抵钉座芯(图2I)。经肛门放置25#吻合器,将直肠断面内翻,于肠管富余侧出吻合器中心杆针(图2J),对接锁定(图2K),击发完成吻合(图2L)。以3-0倒刺线沿吻合口周加固缝合一圈,生理盐水反复冲洗手术视野,探查手术视野无活动性出血,放置盆腔引流,逐层缝合各操作孔。术中出血200 mL,术中未输血。
图2 术中资料。2A:腹部Trocar布孔位置;2B:术中探查肿瘤位置(黄色箭头指向肿瘤);2C:术中游离肿瘤右侧壁;2D:术中电刀导致直肠破口;2E:切除肿瘤后瘤床;2F:将肿瘤置入标本袋经直肠破口从肛门取出;2G:直线切割缝合器在直肠破口上方离断直肠;2H:将直肠外翻拖出肛门外适行离断;2I:电刀打开肠壁露出抵钉座芯;2J:吻合器在肠壁富余侧出中心杆针;2K:抵钉座芯与中心杆针对接;2L:激发吻合器完成肠道重建
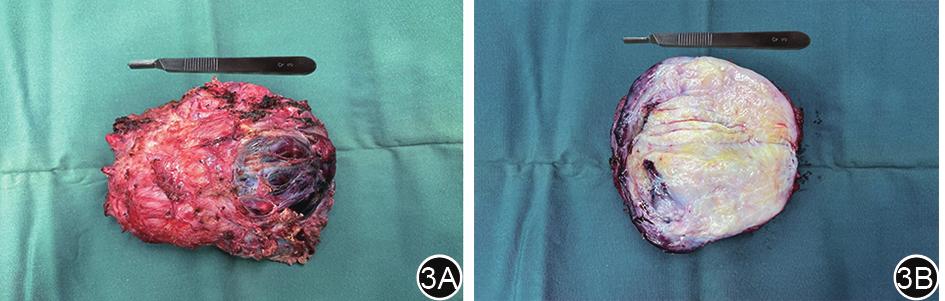
图3 盆腔腹膜后肿瘤标本。3A:肿瘤正面观;3B:肿瘤剖面观
治疗结果:术后第一天排气,术后第二天流食,术后第六天顺利出院。
术后病理:梭形细胞肿瘤,符合深部侵袭性血管黏液瘤肿瘤直径12 cm,侵及直肠肌层,肠管切缘及肿瘤切缘均未见肿瘤,肠周淋巴结0/6。
术后随访:术后随访6个月,未见肿瘤局部复发,肛门功能正常。
三、讨论
手术完整切除肿瘤是目前治疗PRT最有效的方式 [8] 。合理选择手术入路是提高肿瘤切除率、减少副损伤和手术并发症的关键。PRT在盆腔的位置与手术入路的选择最为重要,对于肿瘤下极未突破肛提肌,第四、五骶骨和尾骨未受侵犯者可选择经腹入路;若肿瘤上极位于第三骶骨水平以下且预计上极容易分离者可选择经骶入路;对于肿瘤巨大,单一入路无法完整切除肿瘤者,则多采用经腹经骶联合入路 [9] 。无论经何种手术入路,标本都需从腹部或骶部切口取出,切口的大小与肿瘤直径呈线性相关。除手术入路的选择,标本取出途径也应纳入外科医生的思考之中。目前尽管腹腔镜技术和机器人辅助腹腔镜技术陆续在 PRT 治疗中开始应用,并且相较传统手术具有一定优势,但仍无法避免腹部或骶部切口 [6, 10] 。
随着NOSES技术的不断成熟,NOSES的适应证在不断扩大,目前NOSES适应证已涵盖腹盆腔全部脏器 [1] 。NOSES与常规腹腔镜手术最大区别在于通过直肠、阴道等自然腔道取出标本,避免了腹壁取标本的辅助切口。多项研究显示:NOSES组比常规腹腔镜组术后疼痛更轻,住院时间更短,切口感染发生率更低,术后首次排气时间更短,术后并发症更少,术后效果更美观 [11-12] 。
本病例术后病理证实为AA,属于间叶组织起源的良性肿瘤,年轻女性是AA好发人群,因早期AA无明显症状,患者常因肿瘤增大产生压迫症状而就医,肿瘤多数直径超过 10 cm,手术是治疗AA的主要方式 [13-14] 。由于盆腔狭窄的生理结构和本病发病率低,腹腔镜AA切除的病例极少,而经自然腔道取标本的微创手术迄今未见相关报道。采用传统开放手术至少需20 cm切口;若行腹腔镜下切除,也需在腹部行10 cm辅助切口用以取出标本。手术切口对患者造成的危害主要有三个方面 [15] :首先,切口长度是造成术后疼痛的主要原因之一,切口长度与术后切口并发症的发生有显著相关性。其次,腹壁大切口会造成患者术后恐慌、焦虑等不良情绪,影响患者早期康复及功能锻炼。最后,切口瘢痕形成、切口疝形成,会引起患者生理及心理上的不良感受。
本例肿瘤直径12 cm,但因肿瘤质地软,有可塑性,经肛门取标本的难度并不高,术后患者肛门功能也未出现损伤。该病例成功将NOSES应用于PRT治疗,证明NOSES是治疗PRT可供选择的有效手术方式之一。
扫码观看手术视频
参考文献(见原刊官网,点击“阅读原文”或扫描下方二维码获取)
文章来源:原文刊发于《中华结直肠疾病电子杂志》, 2023, 12(1): 85-88.
二维码
关注CCMTV

CCMTV APP下载

关注CCMTV云管家